周怀荣,马迎文,王可,李红伟,孟文亮,谢江鹏,李贵贤,张栋强,王东亮,赵永臣
(1 兰州理工大学石油化工学院,甘肃 兰州 730050;
2 陕西警官职业学院,陕西 西安 710021)
甲醇及其衍生物可广泛应用于石化和能源化工工业,目前我国已成为世界上最大的甲醇生产国及消费国。图1 表示近年来中国与全球甲醇产能的对比,全球范围内甲醇的产能不断上升,与此同时,中国甲醇产能所占全世界的比例也在不断上升,其中2021 年甲醇产能达到105.75Mt,占全球甲醇产能的56.9%,并且在较长时期我国的甲醇产能将会不断上升。我国生产甲醇的主要原料包括天然气、煤炭、原油、生物质等,由于我国“富煤、贫油、少气”的能源结构促使了煤作为生产甲醇的主要原料,煤制甲醇(CTM)约占全国甲醇生产量的58%。

图1 中国与全球甲醇产能的比较
CTM 工艺包括四个单元,即原煤加工、煤气化制合成气、合成气纯化、甲醇合成。煤制甲醇流程如图2 所示,将原煤送入球磨机中得到磨细、干燥后的煤粉,随后与水混合成水煤浆,制成的水煤浆进入气化炉与来自空分单元的氧气(作为气化剂)发生气化反应,生成粗合成气。粗合成气一部分进入变换单元,进行水煤气变换,生成富氢混合气体,并与未变换粗合成气混合后,进入净化单元,脱除CO与硫化氢等物质,并配比甲醇合成反应合成气氢碳比(H/C,一般为2.0~2.2),得到的净化气进入到甲醇合成单元合成甲醇得到粗甲醇,最后粗甲醇经过精馏得到产品甲醇。
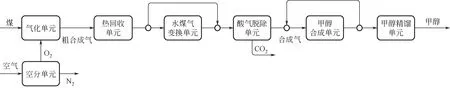
图2 传统煤制甲醇工艺流程框图
传统煤制甲醇工艺中的煤气化单元的重要辅助设备空气深冷分离(CAS)装置使用低温空气分离得到工业上的广泛的认可,并得到技术和商业的支持,被用作工业中常用的制氧装置。然而,低温意味着空分装置能耗大(体积分数为95%的氧气能耗为200kWh/t)。另一方面,不同的学者对煤化工过程CO捕集能耗的研究中发现,捕集前CO浓度低造成了捕集能耗大,从而使捕集投资成本变大。传统水煤气变换单元后会产生大量的CO与H,虽然此时CO浓度得到了提升,但是后续的甲醇合成单元由于需要配H/C,与未变换的合成气混合后会极大降低CO浓度,从而导致CO捕集能耗的增加。总之,传统煤制甲醇工艺主要存在系统能耗大、CO捕集能耗大等问题。如何通过改进传统煤化工工艺,使这些问题得到一定程度的解决,是目前研究的关键。
由于低温空分技术成熟度较高,针对能耗过高问题在原有技术上改进已难以突破,促使研究者们研究可替代技术已成为热点问题,化学链空分(CLAS)因其显著的低投资成本及低能耗等优势,引起了广泛的关注。Newcastle 大学通过实验小试设备,对化学链空分技术进行了一系列的实验及建模研究,得出了CLAS技术具有极大潜力可替代传统空分技术。化学链制氢(CLH)技术可以有效地避免CO浓度被过度稀释,同时可以实现捕集CO与制取H分层处理。俄亥俄州立大学(OSU)通过25kW化学链三反应器小试装置,分别对合成气化学循环工艺以及煤直接化学循环工艺进行了超过850h 的连续实验运行,最终得到了纯度超过99.99%的氢气和100%的碳捕集量。虽然许多学者的研究中发现CLAS相对于低温空分在降低能耗方面以及CLH对于CO捕集率方面均有突出的表现,但是对CO捕集能耗以及化学链技术与煤制甲醇的集成研究报道却较少。本文提出了化学链空分联合化学链制氢的煤制甲醇(CTM)过程,以CLAS替代传统煤制甲醇中的空分单元,来提供氧气,并且将CLH 技术集成到煤制甲醇工艺中,以达到代替变换单元、分层捕集CO和制氢、在最大限度提高CO浓度效果的同时制取纯净的氢气。
1.1 CTMCLAS&H工艺描述
CTM创新工艺是基于以下三点进行设计:①使用化学链制氧单元替换深冷空分单元;
②使用化学链制氢单元替换变换单元;
③甲醇合成中未反应气体遵循适度循环原则。具体流程框图见图3。
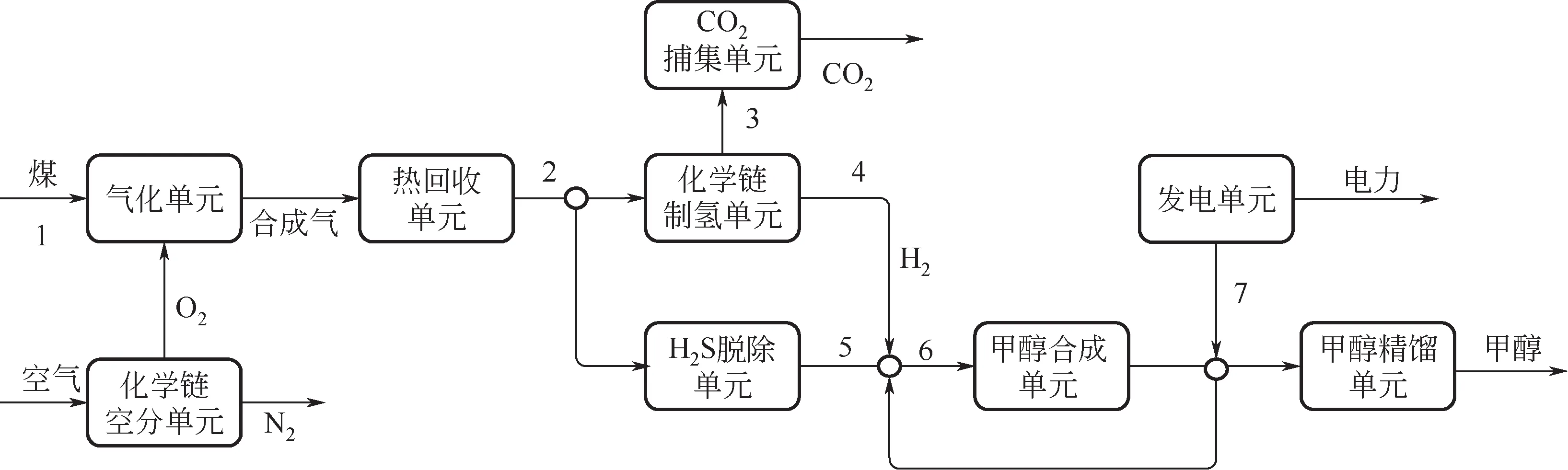
图3 CTMCLAS&H工艺流程框图
化学链空分联合化学链制氢的煤制甲醇工艺流程如图4所示,CTM工艺与CTM工艺相比,用化学链制氧单元替换深冷空分单元,为气化单元提供氧气;
化学链制氢单元替换变换单元,为甲醇合成单元提供H。在化学链制氢单元中的燃烧反应器生成的气体CO含量很高,只要简单地闪蒸操作将HO 分离后直接进行CO的捕集,可使CO捕集能耗极大地降低。在水蒸气反应器中,通过脱除出口气体中的水蒸气就可产生纯净的H。此外,甲醇合成中未反应气体一部分经过压缩循环回反应器继续合成甲醇,剩余的部分气体经燃气和蒸汽轮机联合循环发电。
1.2 过程建模
CTM工艺过程主要包括4个子单元:①煤气化制合成气单元;
②化学链制氧单元;
③化学链制氢单元;
④甲醇合成与分离单元。化学链制氧单元、化学链制氢单元和甲醇合成单元属于首次建模,因此文章中对其进行了详细的建模。CTM工艺流程图如图4所示,过程的物流和能流数据采用模拟软件Aspen Plus(V11)模拟得到。

图4 CTMCLAS&H工艺流程图
1.2.1 煤气化单元
煤气化采用了Texaco 水煤浆气化技术,原煤经研磨机研磨呈具有适当粒度分布的煤粉后加入水混合成一定质量浓度的水煤。由煤浆泵加压送入气化炉,与高压氧气在气化炉中进行气化反应生成粗合成气和熔渣后经过激冷室冷却,熔渣落入激冷室底部冷却、固化后排出,合成气经过喷嘴洗涤器进入碳洗塔中进一步冷却、除尘。建模时,对原煤的工业分析及元素分析如表1所示。

表1 原煤工业分析和元素分析(质量分数)
气化炉采用吉布斯自由能最小化的RGibbs 模型和Peng-Rob 作为物性方法。煤气化反应主要反应如式(1)~式(5)所示。

1.2.2 化学链制氧
化学链制氧(CLAS)是通过氧载体在两个相互连接的反应器之间进行循环氧化还原反应将空气中的氧气分离出来。通常情况下,氧载体的氧化反应发生在氧化反应器(OR)中,还原反应器发生在还原反应器(RR) 中。空气对氧化反应器(OR)中提供足够的氧气来维持再生金属氧载体,金属氧载体在还原反应器(RR)中发生还原反应,水蒸气或CO作为惰性气体被引入用以促进氧气的产生,被还原的金属氧载体会进入到氧化反应器中循环、再生。本工艺中因为MnO/MnO在温和条件下表现出较高的反应速率,所以选择其为金属氧载体,水蒸气作为惰性气体被引入到还原反应器(RR)中在,氧化反应器中发生反应如式(6)表示。在还原反应器中的反应如式(7)表示。

氧化反应器(OR)与还原反应器(RR)均采用采用吉布斯自由能最小化的RGibbs模型和Peng-Rob作为物性方法。
1.2.3 化学链制氢
来自煤气化的粗合成气经过洗涤、脱硫后,通过压缩机进入CLH 单元。合成气在FR(RGibbs 模型)中被FeO氧化为CO和HO,使用旋风分离器(Cyclone模型)进行气固分离。假定气固分离是完全的,产生的气体换热后经压缩机进入闪蒸罐,将水蒸气和CO分离。还原态的氧载体进入SR(RGibbs 模型)中,Fe、FeO 与通入的水蒸气发生反应,出口气体是H与水蒸气的混合物,经旋风分离器将FeO与气体混合物分离。气体混合物经换热器后由压缩机输送到闪蒸罐,将H与水蒸气分离,得到高纯度H。FeO进入空气反应器(FR)中,与空气中的O发生强放热反应,将其完全氧化。经旋风分离器进行气固分离后,高温高压的欠氧空气进入废热锅炉(Heax 模型)回收热量后排出,FeO将循环进入到燃烧反应器(FR)中。对于载氧体的主要选择有Ni基、Cu基、Fe基、Mn基、Cr基载氧体,而Fe基载氧体因为价格便宜、反应活性好等优点,所以FeO/FeO被选为本工艺的载氧体。在燃烧反应器(FR)中发生的反应如式(8)~式(11)所示。在水蒸气反应器(SR)中发生的反应如式(12)、式(13)所示。在空气反应器(AR)中发生的反应如式(14)所示。

燃烧反应器(FR)、蒸汽反应器(SR)、空气反应器(AR)建模均采用吉布斯自由能最小化的RGibbs模型和Peng-Rob作为物性方法。
1.2.4 甲醇合成
部分粗合成气与经化学链产氢脱碳单元所产生的氢气混合后,配比成符合甲醇合成的H/C 为2.0左右,经压缩机加压后通过气气换热器预热进入甲醇反应器,在以铜基催化剂的甲醇合成反应器中的反应是如式(15)~式(17)所示。
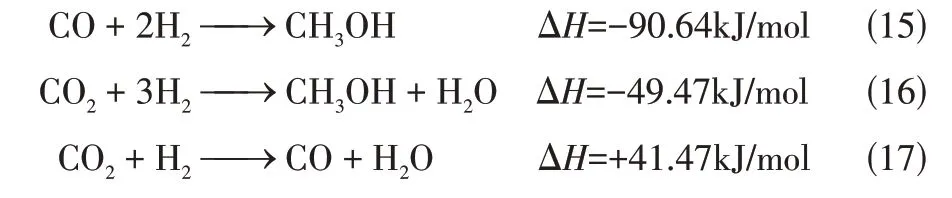
相应的使用LHHW型动力学模型,如式(18)、式(19)。

未反应的合成气与产物甲醇冷却后进入汽液分离器。分离出部分未反应的合成气通过压缩机循环返回,并且与新鲜原料气混合后进入合成反应器,剩余的未反应气经过发电单元,底部出来的粗甲醇进入甲醇精馏过程。在对甲醇合成反应器建模中,采用RPlug模型,物性方法为SRK。
氧煤比(O/C)是煤气化的主要工艺参数,图5 表示了水煤浆质量分数为65%时O/C 对煤气化合成气主要组分摩尔流量和反应器温度的影响。随着O/C从0.6增加到0.9,CO、H的摩尔流率呈现先上升后下降的趋势,HO、CO的摩尔流量呈上升趋势。当O/C为0.7时,CO、H的摩尔流量达到最大值。当O/C 从0.7 增加到0.9 时,CO、H摩尔流量均呈下降的趋势,而CO摩尔流量、温度呈不断上升趋势。因为氧煤比的增加意味着进入气化炉的氧气含量增加,这会使气化炉内反应加剧,更多的CO 与O反应生成CO,H与O反应生成HO,同时反应加剧会导致会产生更多的反应热,导致气化炉温度不断上升。由于水煤浆气化炉温度要求在1300~1500℃之 间,当O/C 为0.7 时,温 度 为1354.3℃,此时,氢碳原子摩尔之比为0.84,符合工业要求,因此本次模拟O/C选择0.7。

图5 O/C对煤气化合成气主要组分摩尔流量和反应器温度的影响
图6 表示还原反应器中在不同还原温度下MnO转换率随着蒸汽与MnO的摩尔比(蒸汽/MnO)的变化。在相同温度下,随着蒸汽/MnO比增加,MnO转换率呈上升的趋势;
在同一蒸汽/MnO比下,由吸热特性可知,温度越高,MnO转换率越高,说明在一定范围内提高还原温度可以促进还原反应的进行。化学链制氧燃烧反应器出口温度可达到1000℃左右,满足还原反应器中蒸汽和MnO在较高反应温度下进行反应。因此,考虑到MnO转化率需达到99%以上,以及蒸汽的消耗量最少,本文中化学链制氧单元的还原反应器温度选择为830℃,蒸汽/MnO选择为0.3。
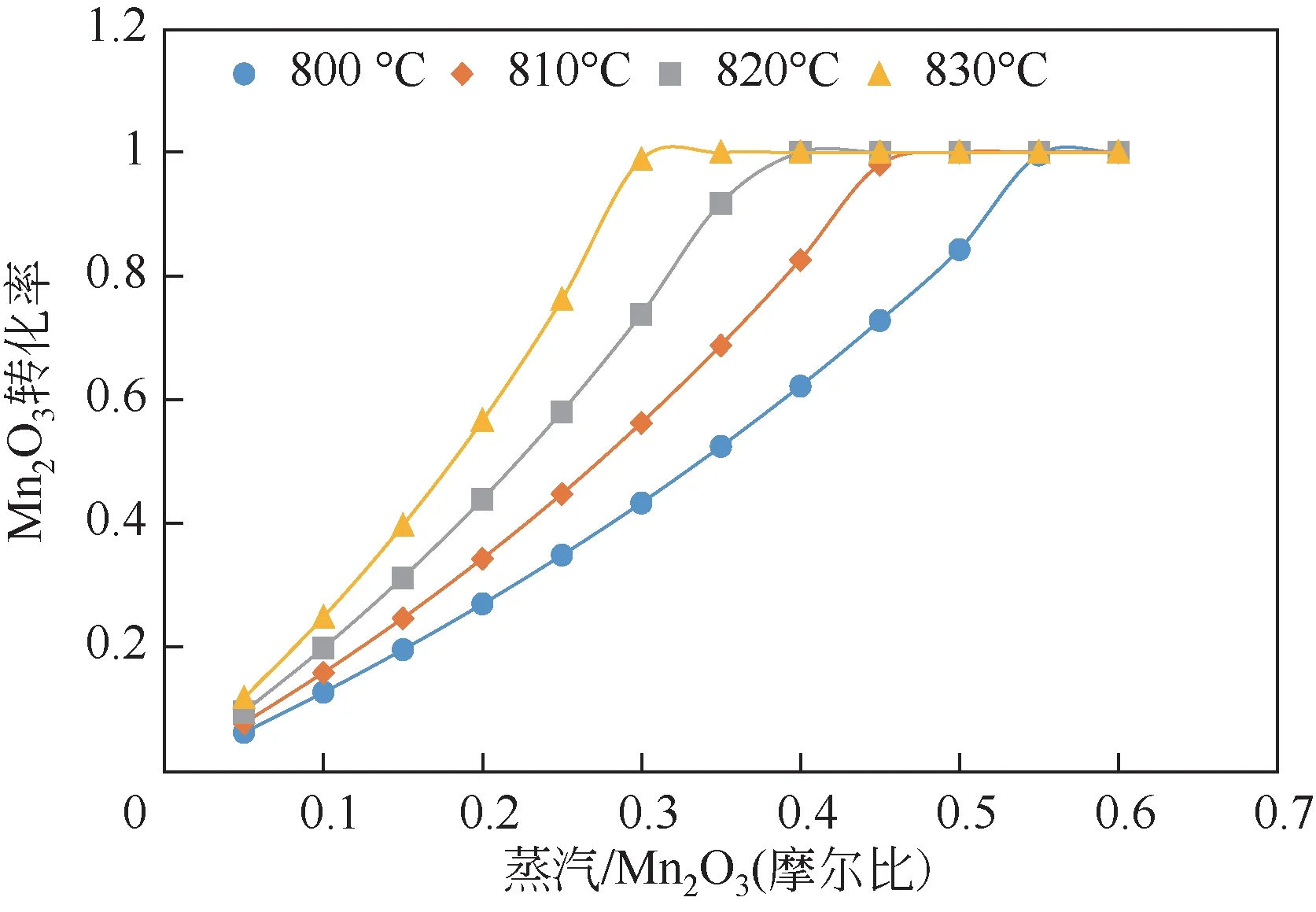
图6 Mn2O3转换率随着蒸汽/Mn2O3比的变化
图7 表示在不同的质量比空气/MnO下对MnO与空气中O的转化率的影响,O的转化率随着空气/MnO的增加呈现出不同幅度的下降趋势,而MnO转化率呈现出不同幅度的上升。当空气/MnO由0.05增加到0.1,O的转化率下降趋势幅度很大,这是由于过量的MnO促使反应速率加快,吸氧效率变高,由0.987 下降到0.594。当空气/MnO由0.1 增加到0.2,O的转化率缓慢下降,转化率降至0.54后趋于平缓。空气/MnO由0.05增加到0.25,MnO转化率由0.178 增至0.89。当空气/MnO为0.3 时,MnO转化率达到1,因此选择空气/MnO为0.3。
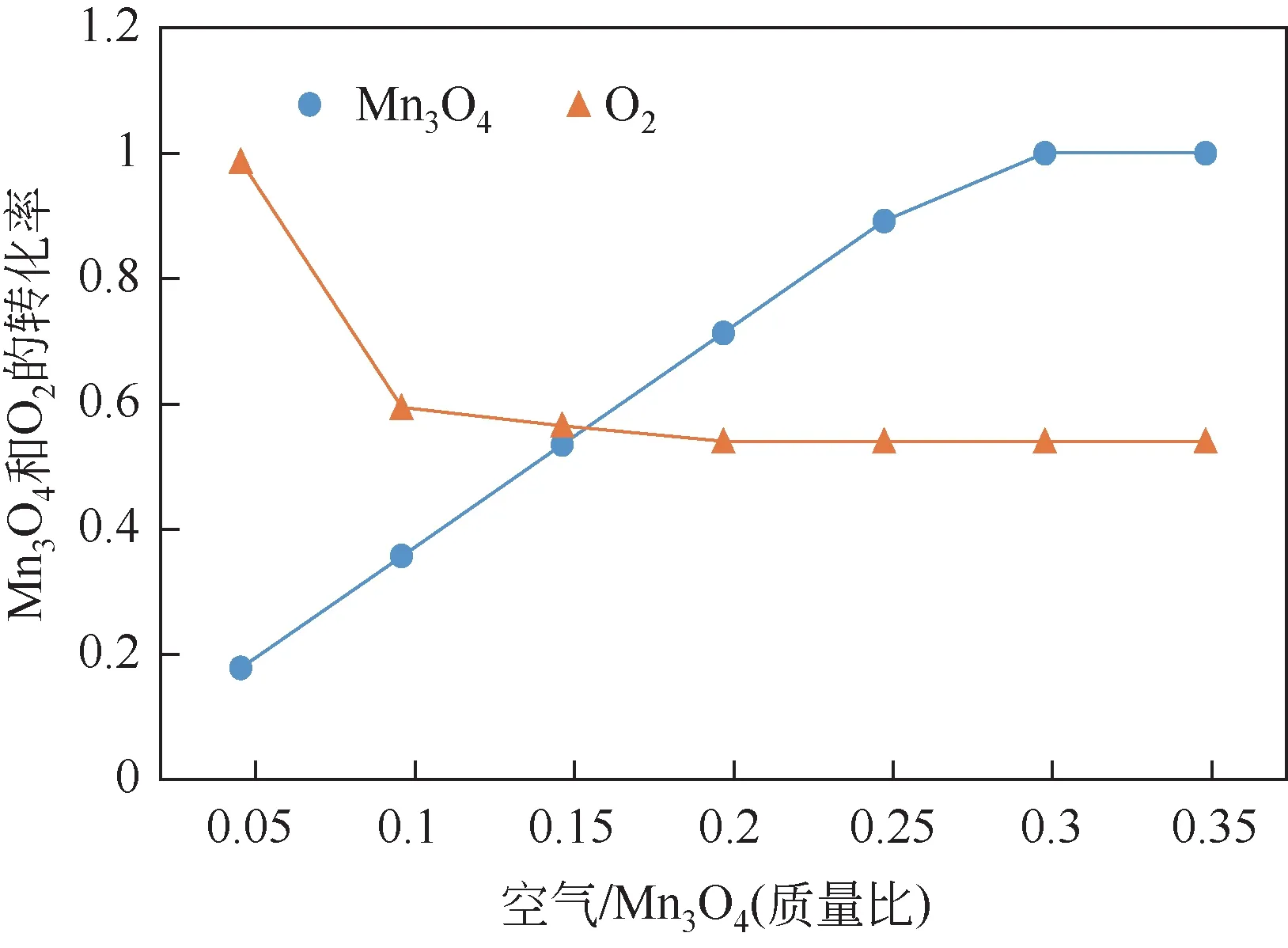
图7 不同空气/Mn3O4比对Mn3O4和O2的转化率的影响
为了达到合适的H/C,通过变换操作是必要的,化学链制氢可以替换传统变换单元,化学链制氢主要是由燃烧反应反应器(FR)与蒸汽反应器(SR)分两步进行。图8研究了在不同的FeO与粗合成气摩尔比(FeO/粗合成气)下对参与反应的主要气体的摩尔流量与燃料反应器(FR)热负荷的影响。从图中所示的结果表明,H与CO的摩尔流量随着FeO/粗合成气的增加而降低,当FeO/粗合成气为0.3~0.35 时,H与CO 摩尔流量变化缓慢。CO、HO的摩尔流量随着FeO/粗合成气的增加而增加,当FeO/粗合成气为0.3~0.35 时,CO、HO 摩尔流量变化趋于平缓,这是由于当FeO/粗合成气为0.3 时,H与CO 在反应器中的摩尔流量极低,反应达到极限。而反应热负荷随着FeO/粗合成气的增加而增加,当FeO/粗合成气为0.3~0.35 时,热负荷增加幅度较大。因此选择FeO/粗合成气为0.3。

图8 Fe2O3/粗合成气对参与反应的主要气体的摩尔流量与燃料反应器热负荷的影响
图9研究了在SR中不同的蒸汽与(FeO+Fe)质量比[蒸汽/(FeO+Fe)]下对蒸汽、FeO和Fe转化率的影响及产生氢气的摩尔流率影响。在图9 中可以看出,FeO 的转化率并未变化,在FR 中的反应,FeO与过量的合成气经过反应生成FeO,随后FeO与剩余的合成气反应生成Fe。加入蒸汽后FeO 比Fe 更早彻底反应,Fe 的转化率与H的摩尔流量随着蒸汽/(FeO+Fe)的增加到0.7 时,逐渐趋于平缓,此时Fe 转化率可以达到0.91,剩余部分Fe 将会在空气反应器中完全生成FeO。因此,蒸汽/(FeO+Fe)最终选择为0.7。

图9 蒸汽/(FeO+Fe)对蒸汽、FeO、Fe的转化率以及H2产量的影响
通过对煤的元素分析可知,煤的氢碳原子比一般为0.2~1.0,进入甲醇合成之前必须有调整氢碳比(H/C)的过程,来达到增产甲醇的目的。图10表示了在分流比在0.1~0.7 下对进入甲醇合成单元的主要气体与甲醇的摩尔流量以及H/C 的影响,分流比表示进入化学链制氢单元的合成气流量与总合成气的比,图中可以看出,随着的增加,H的流量逐渐增加在大于0.6时趋于平缓,而CO与CO的摩尔流量呈不断下降的趋势,甲醇的摩尔流量呈先增加后下降的趋势,当分流比为0.5时,甲醇摩尔流量最大。本次模拟分流比选择0.5。
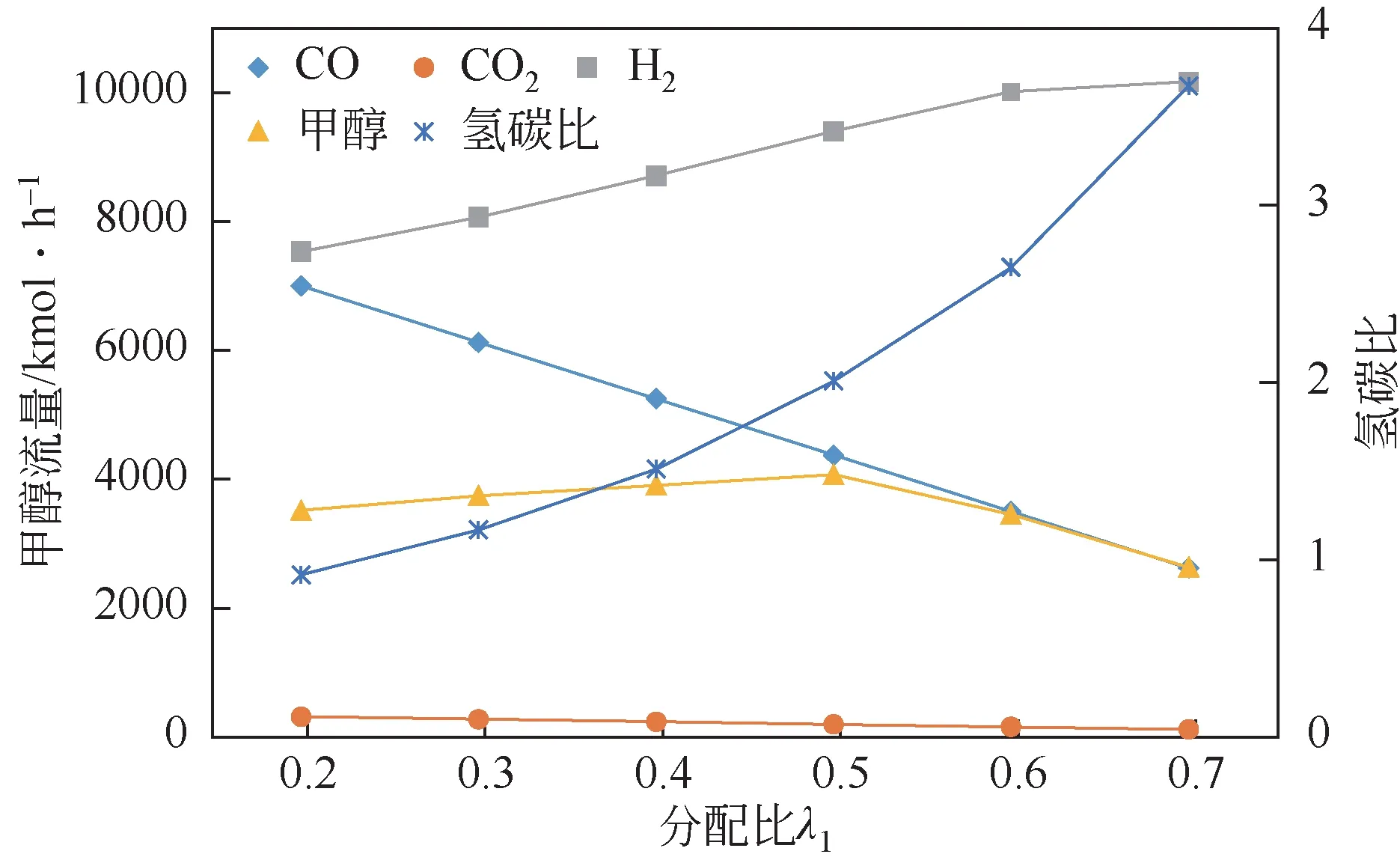
图10 λ1对甲醇的摩尔流量以及H/C的影响
由于甲醇合成是一个可逆反应,所以应对未反应的气体进行循环处理来达到提高甲醇生产效率。图11 表示在分流比(未反应气体的循环分率)在0.55~0.95 之间的变化对甲醇的摩尔流量以及压缩机能耗的影响。从图中可以看出,随着的增加,甲醇的摩尔流率与过程能耗都呈上升趋势,当大于0.85 后,甲醇的摩尔流量上升趋势变得缓慢。同时,甲醇合成过程的能耗的增长幅度变大。可以看到循环比的增加虽然可以增加甲醇产量,但是一味地增加循环必然会极大地增加压缩机能耗,为了系统的稳定性及能效考虑,循环比应为0.85,剩余部分气体即驰放气回收利用,用于发电。

图11 λ2对甲醇的摩尔流量以及压缩机能耗的影响
依据以上分析,通过过程模拟得到最终的模拟结果如表2,物流号对应图3物流号。

表2 CTMCLAS&H过程主要物流模拟数据
3.1 碳元素利用率
碳元素利用率是考察CTM 与CTM工艺的一项必要指标,可以由式(20)计算。

式中,为碳元素利用率;
为甲醇中碳元素的流量,kmol/h;
为煤中的碳元素的流量,kmol/h。图12对比了CTM工艺与CTM工艺甲醇的生产量和碳元素的利用率,输入系统中的碳元素流量均为10938.2kmol/h,进入甲醇合成单元的碳元素流流量4573.71kmol/h,最终得4040.12kmol/h 的甲醇,碳元素利用率为37%,未利用的碳一部分进入CO脱除单元,这部分碳占输入系统碳元素的49%,传统工艺最终得到3907.89kmol/h 甲醇,碳元素利用率为35.7%。对比传统工艺,碳元素利用率提升幅度不大,仅提高1.3 个百分点。这是由于如果要提升碳元素利用率,就需要对工艺补充外来氢气,从而降低进入制氢单元的合成气流量,以此提高进入甲醇合成单元的碳元素流量,碳元素利用率会因此增大,本工艺并不涉及补氢来源,因此保持与传统碳元素利用率相同。

图12 CTM与CTMCLAS&H工艺碳元素利用率
3.2 二氧化碳排放量
二氧化碳排放量的计算包括直接排放和间接排放,如式(21)所示。


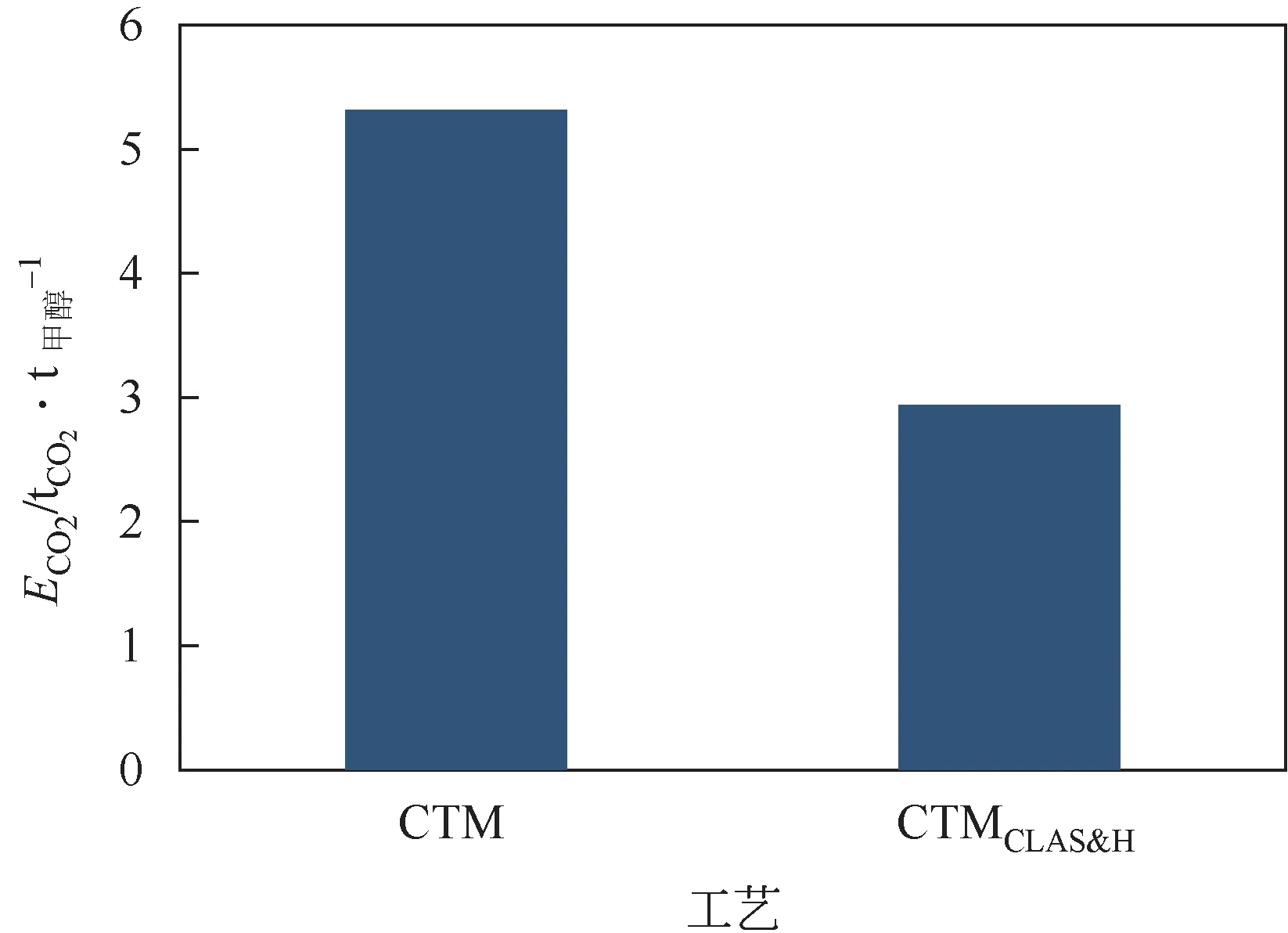
图13 CTM与CTMCLAS&H工艺的CO2排放量
3.3 制氧能耗
制氧能耗作为本文分析化学链空分过程的重要指标,可由式(22)计算。

其中,表示输入的空气的能量;
表示空分单元输入的公用工程的能量,对于化学链空分,包括表示水蒸气。对于低温空分,包括空气压缩循环制冷所需的电力;
表示氧气的质量流量。图14表示CLAS单元与CAS单元的能耗对比,从图中可以看出,CLAS单元的制氧能耗为0.24GJ/t,而低温空分单元的制氧能耗为0.41GJ/t,相比CAS 单元,CLAS 单元的能耗降低了40.7%,这是由于CAS单元需要对空气压缩循环制冷及分离,这个过程需要消耗大量的电力,且整个操作过程中能耗较大,而CLAS单元的空气不需要经过压缩,整个单元主要消耗水蒸气,并且大部分热量是由载氧体氧化过程放出的热量提供,能耗方面得到极大的降低。
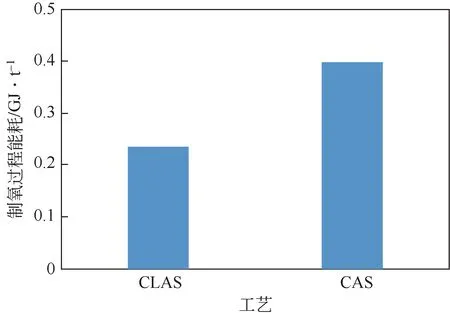
图14 CLAS制氧单元与CAS单元的能耗
3.4 CO2捕集能耗分析
CO捕集能耗作为本文分析重要指标,本文所研究CO捕集是可视为气体分离的情况,因此最小CO捕集能耗是从混合气体中分离出目标组分的所需的最小热力学功,可由式(23)计算。
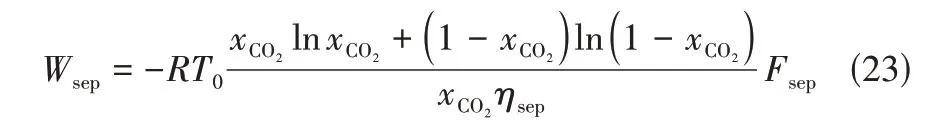
式中,为摩尔气体常数,8.314J/(mol·K);
为298.15K;
为分离气体中二氧化碳的浓度;
为需要分离气体的摩尔流速;
为分离效率。需要注意的是,应用此公式基于假定:混合气体的组成是由CO以及除了CO以外与其他气体视为惰性组分的二元混合物。图15表示在相同的CO捕集率下对比CTM与CTM工艺对CO捕集能耗。从图中可以看出,CTM工艺的CO捕集能耗为1.18GJ/t,而CTM工艺仅为0.127GJ/t,相比CTM 工艺CO捕集能耗降低了89%。从式(23)可以看出,对于CO捕集能耗影响的主要参数是分离前CO浓度、合成气的流量、分离效率。本次分析采取相同的分离方式,分离过程效率相同。首先CTM工艺分离前CO的体积分数达到了91.5%,而CTM 工艺分离前CO体积分数为29.5%,CTM工艺粗合成气在化学链制氢工段的燃烧反应器反应后,得到CO浓度很高的混合气体,此时分离,分离前浓度是传统工艺的3.1倍,并且CTM 工艺进入化学链制氢工段合成气的流量为8906.33kmol/h,相比传统工艺合成气流量下降了23.3%,所以新工艺捕集CO能耗为旧工艺的10.8%。
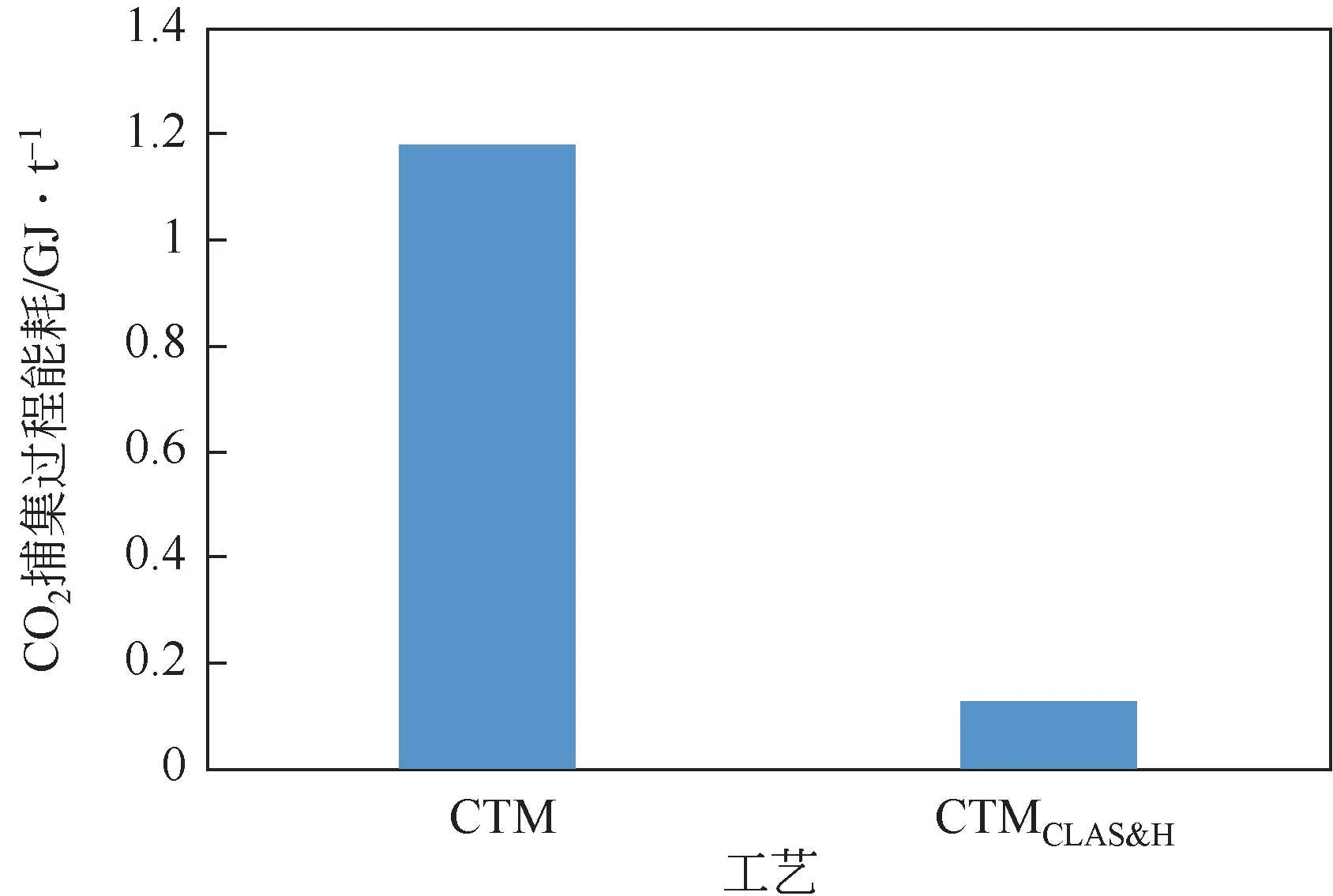
图15 CTM工艺与CTMCLAS&H工艺的CO2捕集能耗
3.5 能量效率分析
能量效率是对比CTM 工艺与CTM工艺的重要指标,本文考察加CO捕集与不加CO捕集单元的CTM工艺与CTM能量效率,其中不加CO捕集工段能量效率计算见式(24),加CO不计工段能量效率计算见式(25)。

式中,为不加CO捕集单元时系统的能量效率,%;
为不加CO捕集单元时系统的能量效率,%;
为产品能量与输出电力之和;
为煤的能量;
为公用设施输入能量(包括水蒸气和电);
为捕集CO输入的能量。
考察相同进煤量的CTM工艺与传统工艺的能量效率对比,图16表示在没有CO捕集单元的能量效率对比,CTM工艺的能效达到54%,传统工艺能量效率为47.3%,能效量效率提高14.1%。能量效率的提高主要因为化学链制氧代替空分单元,在甲醇合成单元中,选择适度的循环比减小压缩机能耗,分流出部分气体进行发电;
同样,用废热锅炉代替热电站并且对高温合成气经过废热锅炉,使部分热量回收后,所产成的高压蒸汽经过透平机发电,发电为系统提供了一部分电力,减少共用工程的消耗,进一步减少能量损失。在有CO捕集单元的能量效率对比,CTM工艺的能量效率达到53.7%,传统工艺能量效率为45.5%,能效量效率提高18%。相对于不加CO捕集,CTM工艺能量效率降低了0.3%,而传统工艺降低了1.8%,因为传统工艺中CO浓度被过度稀释,导致分离难度增加,捕集能耗随之增加,过程能量效率变化幅度较大,而CTM工艺由于在捕集过程中,CO浓度极高,极大地降低捕集能耗,过程效率变化幅度并不明显。

图16 TM工艺与CTMCLAS&H工艺的能量效率
本研究提出了一种化学链制氧联合化学链制氢的煤制甲醇工艺,该工艺用CLAS替换传统CTM工艺中的低温空分单元,达到部分提升工艺能量效率的目的;
用CLH替换传统CTM工艺中的变换单元,分层进行对捕集CO和制H,得到高浓度CO以及高纯度的H,从而降低了CO捕集能耗。通过对CTM工艺进行建模及技术性能分析,得出以下结论。
(1)通过建模和模拟,得出了最佳分流比=0.5,即进入化学链制氢单元的粗合成气占比为0.5;
最佳分配比=0.85,即甲醇合成未反应合成气循环量占比0.85,未循环气体被用于发电,极大程度降低压缩机能耗的同时,为CTM工艺提供部分电力。
(2) 在同一碳输入量的情况下,CTM 和CTM工艺的碳元素利用率分别为35.7%和36.93%,由于未有补氢单元,故碳元素利用率并无明显变化。对CO排放量进行分析,结果显示CTM 和CTM工艺的CO排放分别为5.31t/t 甲醇和2.94t/t 甲醇。相比CTM 工艺,CTM工艺的CO排放量降低了44.6%。
(3)CTM工艺中的CLAS 单元制氧能耗为0.24GJ/t,而深冷空分制氧单元能耗能耗为0.407GJ/t,相比CAS 单元,CLAS 单元的能耗降低了40.7%。
(4)CTM工艺的CO捕集能耗为0.13GJ/t,而传统工艺CO捕集能耗为1.18GJ/t。相比CTM 工艺,CTM工艺的CO捕集能耗降低了89%。
(5)能量效率分析得出当不考虑CO捕集能耗时CTM的能量效率达到54%,传统工艺能量效率为47.3%,能效提高14.1%。当考虑二氧化碳捕集能耗时,CTM的能量效率达到53.7%,CTM工艺能量效率为45.5%能效提高18%。
猜你喜欢 反应器甲醇摩尔 硅胶吸附管采集甲醇汽车尾气排放中甲醇的方法研究汽车实用技术(2022年4期)2022-03-07浅谈天然气制甲醇与煤制甲醇的区别E动时尚·科学工程技术(2019年11期)2019-09-10低温甲醇洗装置甲醇消耗高原因与应对措施进出口经理人(2017年7期)2017-09-20EGSB反应器的应用研究建筑建材装饰(2016年10期)2017-01-03化学反应工程精要,练习和范例国外科技新书评介(2016年8期)2016-11-16环流反应器研究进展当代化工(2015年9期)2015-07-10改进型ABR处理太湖富藻水启动研究湖南大学学报·自然科学版(2014年3期)2014-12-30甲醇生产精馏操作技术探讨城市建设理论研究(2014年25期)2014-09-24我对亨利.摩尔艺术特色的解读雕塑(2000年4期)2000-06-24亨利.摩尔雕塑(2000年4期)2000-06-24